2.4.2 Was ist Verbrennung?
Inhaltsübersicht
Im Jahre 1783 gelang es dem Franzosen A.L. Lavoisier, den Verbrennungsvorgang aufzuklären. Er erkannte die richtigen Zusammenhänge, die zu unserem heutigen Wissen über die Verbrennung geführt haben:
»Bei der Verbrennung verbindet sich ein bestimmter Teil der Luft (>Sauerstoff<) unter Wärmeabgabe mit dem brennbaren Stoff.«
Er erkannte, dass die Verbrennung von Stoffen eine Vereinigung mit Sauerstoff ist. Entsprechend dem französischen Namen oxygène für Sauerstoff wurde diese Vereinigung mit Sauerstoff als Oxidation bezeichnet. Es wird dabei chemische Energie in Form von Wärme und Licht frei, man nennt so eine Reaktion exotherm.
Beispiel: 2 H2 + O2 → 2 H2O + Wärme (Feuererscheinung) = Knallgasreaktion |
|---|
Es verbinden sich dabei zwei Wasserstoffmoleküle (H2) unter Abgabe von Licht und Wärme mit einem Sauerstoffmolekül (O2).
Die gegenteilige Bedeutung des Begriffs »Oxidation« stellt die Reduktion dar. Sie beschrieb ursprünglich nur die Zurückführung eines Metalloxides auf das entsprechende Metall (Metallgewinnung), bezeichnete dann aber allmählich jede Abspaltung von Sauerstoff aus einer Verbindung.
Bei den Oxidationen mit Sauerstoff unterscheidet man (aufgrund der Temperaturentwicklung) zwischen der langsamen Oxidation (Verrottung, Korrosion, Atmung) und der raschen Oxidation, mit intensiver Wärme- und Lichtentwicklung, der Verbrennung oder einer Explosion.
Für das Brennen ist also entscheidend, wie groß die Oxidationsgeschwindigkeit ist. Brennen ist demnach ein Sonderfall der Oxidation, bei der die Oxidationsgeschwindigkeit so groß ist, dass die dabei frei werdende Wärme als Feuererscheinung in Form von Glut oder Flamme zu beobachten ist.
Nun gibt es aber auch chemische Reaktionen mit Feuererscheinungen ohne Beteiligung von Sauerstoff. So geht beispielsweise die Vereinigung von Wasserstoff und Chlor (Cl7) explosionsartig vonstatten:
Beispiel: H2 + Cl2 → 2 HCl + Wärmeenergie (Feuererscheinung) |
|---|
Der Energiegewinn ergibt sich hierbei, ebenso wie bei der Oxidation unter Beteiligung von Sauerstoff, durch den Elektronenaustausch der Reaktionspartner.
2.4.2 Was ist Verbrennung? – Seite 2 – 01.04.2010>>Die Reaktionen, die bei Verbrennungen, und besonders Reaktionen, die in der Flamme ablaufen, sind in der Regel Radikalreaktionen. Radikale sind Atome, die ungepaarte Elektronen enthalten und deshalb extrem reaktionsfreudig sind. Bei langsamen Oxidationen kommt es in der Regel nicht zu einer Radikalreaktion. Es gibt auch Reaktionen, die denen der Oxidation und Reduktion sehr ähnlich sind, bei denen aber kein Sauerstoff beteiligt ist. So verbrennt z.B. eine Kerze (oder auch Wasserstoff oder Schwefel) in Chlor fast genauso gut wie an der Luft. Deshalb wurden die Begriffe »Oxidation« und »Reduktion«, die sich vorerst ausschließlich auf den Sauerstoff bezogen (Sauerstoffkonzept), neu definiert. Unter einer Oxidation versteht man eine Reaktion, bei der einem Teilchen (Atom, Atom-Ion) Elektronen entzogen werden.
Im Gegensatz dazu werden bei einer Reduktion Elektronen aufgenommen. Da aber Oxidationen und Reduktion immer gekoppelt verlaufen, fasst man solche Reaktionen als Redoxvorgänge auf, bei denen allgemein eine Elektronenverschiebung auftritt.
Wie vorher schon erwähnt, handelt es sich bei der Verbrennung um eine chemische Reaktion, bei der sich ein brennbarer Stoff mit Sauerstoff verbindet und Verbrennungsprodukte entstehen. Wie bei jeder Reaktion ist auch die der Verbrennung mit einem Energieumsatz verbunden.
Aggregatzustand des brennbaren Stoffes
Flamme ist der Bereich brennender oder anderweitig exotherm reagierender Gase oder Dämpfe, von denen eine sichtbare Strahlung ausgeht. Glut ist ein erwärmter fester oder flüssiger Stoff mit sichtbarer Wärmestrahlung. Es ist also notwendig, die Art der Feuererscheinung eines brennbaren Stoffes zu erkennen bzw. vorherzusehen. Je nach dem Aggregatzustand der Stoffe – fest, flüssig oder gasförmig – lassen sich bestimmte Abhängigkeiten in der Art der Feuererscheinungen feststellen. Tabelle 1 gibt darüber einen Überblick.
Die sichtbare Strahlung einer Flamme und damit auch die erhöhte Energieeinwirkung auf die Umgebung ist nur so lange vorhanden, wie die chemische Reaktion zwischen den brennbaren Gasen oder Dämpfen und dem Sauerstoff anhält. Dagegen wird sich der Energiezustand beim festen Stoff in Abhängigkeit von seiner Kompaktheit nur sehr langsam ändern. Damit hält die Einwirkung auf die Umgebung auch nach Unterbrechung der chemischen Reaktion länger an. Hierauf beruht ganz allgemein die Gefahr der Rückzündung durch stark erwärmte feste Stoffe bei einem Brandfall. Ebenso bleibt der Erfolg erstickender Löschmittel bei Stoffen, die mit Glut brennen, zweifelhaft.
In der Definition für das Brennen nach DIN 14011 werden lediglich zwei notwendige Reaktionspartner für das Brennen angesprochen, nämlich der brennbare Stoff und der Sauerstoff. Setzt man sich mit dem Vorgang des Brennens genauer auseinander, stellt man fest, dass zwischen beiden Reaktionspartnern ein bestimmtes Mengenverhältnis erforderlich ist.
2.4.2 Was ist Verbrennung? – Seite 3 – 01.04.2010<<>>Tab. 1: Zusammenhänge zwischen Aggregatzuständen brennender Stoffe und beobachteter Feuererscheinungen
Aggregatzustand des brennbaren Stoffes | Verbrennung/Feuererscheinung | Beispiele |
|---|---|---|
gasförmig Brennstoffe (Gase/Dämpfe) | nur mit Flamme | Wasserstoff |
flüssige Brennstoffe | nur mit Flamme, | Benzin |
feste Brennstoffe | je nach Art des Stoffes unterschiedlich mit Flamme und mit Glut, | |
nur mit Glut | Koks | |
nur mit Flamme, | Teer | |
mit Flamme und Glut, | Holz | |
Außerdem wird man erkennen, dass die Reaktion mit Flamme und/oder Glut nur dann selbstständig abläuft, wenn dieses Mengenverhältnis auf seine Zündtemperatur erwärmt wird. Brennen ist also nur möglich, wenn die folgenden vier Vorbedingungen gleichzeitig erfüllt sind:
brennbarer Stoff
Sauerstoff
richtiges Mengenverhältnis
Zündenergie
Außerdem spielen beim Brennen gewisse reaktionsbeschleunigende bzw. -hemmende Stoffe eine entscheidende Rolle.
2.4.2 Was ist Verbrennung? – Seite 4 – 01.04.2010<<>>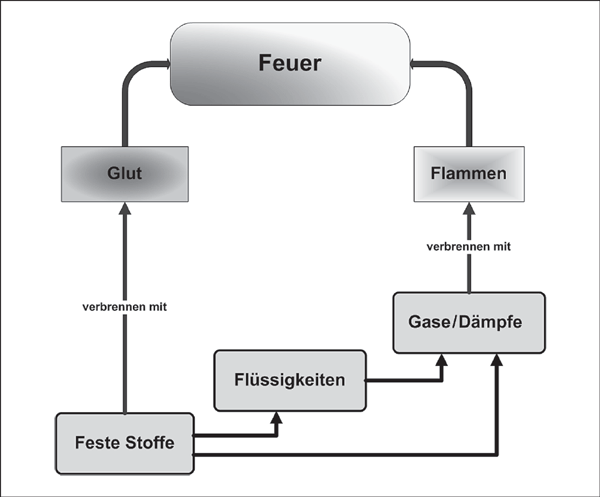
2.4.2.1 Energieumsatz bei chemischer Reaktion
Bei jeder chemischen Reaktion ist der Energiegehalt der Edukte (Ausgangsstoffe) verschieden dem der Produkte. Es wird entweder Energie frei oder es wird Energie verbraucht.
Jeder Stoff bzw. jedes stoffliche System hat einen bestimmten Energiegehalt, der als Enthalpie H bzw. Innere Energie U bezeichnet wird. Während einer Reaktion ändert sich der Betrag der Inneren Energie der beteiligten Stoffe.
Stoffumwandlungen bei chemischen Reaktionen ergeben in der Regel eine Differenz der Inneren Energie bei den Edukten und den Produkten, die Folge ist ein Energieumsatz. Reaktionen können bei konstantem Druck oder unter konstantem Volumen ablaufen.
Bei den Reaktionen, die bei konstantem Druck ablaufen, bezeichnet man den daraus resultierenden Energieumsatz als Reaktionsenthalpie oder Reaktionswärme ΔH1. Bei denen, die unter konstantem Volumen ablaufen, bezeichnet man den daraus resultierenden Energieumsatz als Reaktionsenergie ΔU.
2.4.2 Was ist Verbrennung? – Seite 5 – 01.04.2010<<>>»Der Energieumsatz bei konstantem Druck (AH) ist im Allgemeinen kleiner als der bei konstantem Volumen. AH ist um den Energiebetrag kleiner, der aufgewendet werden muss, um das Volumen des Systems, bei konstantem Druck, zu vergrößern (Volumenarbeit).«
Daher gilt: ΔH = ΔU + p · ΔV
2.4.2.2 Exotherme und endotherme Reaktion
Wird bei einer Reaktion Energie frei, spricht man von einer exothermen Reaktion. Exotherm bedeutet, dass chemische Energie in Form von Wärme freigesetzt wird, d.h., Verbrennungsreaktionen sind immer exotherm. Der frei werdende Energiebetrag erhält in der Reaktionsgleichung ein negatives Vorzeichen.
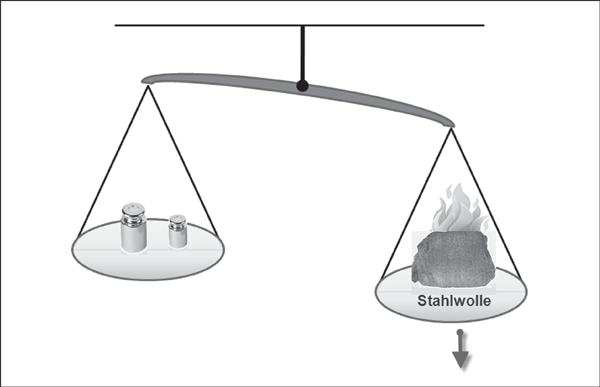
Diesen Vorgang kann man mit dem in Abbildung 2 dargestellten einfachen Versuch anschaulich machen. Eine bestimmte Menge loser Stahlwolle, die sich an einem Waagebalken im Gleichgewicht befindet, wird zum Brennen gebracht. Die Seite mit der Stahlwolle neigt sich nach unten, wird also schwerer. Wie ist die Gewichtszunahme zu erklären? Sie ist auf die Menge Sauerstoff zurückzuführen, mit der sich die Stahlwolle nach ihrem Entzünden aus der Luft zu einem Oxid verbindet. Dies lässt sich in der folgenden Gleichung darstellen:
4 Fe + 3 O2 -> 2 Fe2O3 + Wärmeenergie
Wird bei einer Reaktion Energie verbraucht, spricht man von einer endothermen Reaktion. Der verbrauchte Energiebetrag erhält ein positives Vorzeichen.
Für exotherme Reaktionen gilt ΔH < 0 und für endotherme Reaktionen ΔH > 0. Verbrennungsreaktionen sind immer exotherme Reaktionen, es wird Energie in Form von Wärme und Licht bei der Verbrennung frei. Im Allgemeinen laufen Verbrennungsreaktionen bei annähernd konstantem Druck (Atmosphärendruck) ab. Daher erhält der Energieumsatz immer ein negatives Vorzeichen.
Man unterscheidet zwischen zwei Werten, die den Energieumsatz einer Verbrennungsreaktion angeben: dem Heizwert Hi2 und dem Brennwert Hs3.
2.4.2.3 Brennwert Hs und Heizwert Hi
Der Brennwert Hs [J-kg-1] (veraltet kalorischer Brennwert oder oberer Heizwert Ho) ist ein Maß für die spezifisch je Bemessungseinheit in einem Stoff4. Beim vollständigen Verbrennen eines Stoffes, gleichgültig, ob dies langsam oder schnell geschieht, wird eine bestimmte Wärmemenge frei, die Verbrennungswärme.
Hinweis:
Der Heizwert Hi [J-kg-1] (umgangssprachlich unpräzise »Energiegehalt« oder »Energiewert« genannt) ist die bei einer Verbrennung maximal nutzbare Wärmemenge, bei der es nicht zu einer Kondensation des im Abgas enthaltenen Wasserdampfes kommt, bezogen auf die Menge des eingesetzten Brennstoffs (in Unterscheidung zum Brennwert, welcher deshalb größer als der Heizwert ist).
Der Heizwert ist also das Maß für die spezifisch je Bemessungseinheit nutzbare Energie. Der Heizwert sagt nichts aus über die Verbrennungsgeschwindigkeit. So beträgt der Heizwert des Sprengstoffs Trinitrotoluol (TNT) nur ein Viertel des Wertes von Holz.
Die Verbrennungswärme gibt an, wie viel Wärmeenergie beim vollständigen Verbrennen einer bestimmten Menge eines Stoffes (1 kg, bei Gasen 1 m3 bei 0 ˚C und 1.013 mbar) frei wird.
Der Brennwert ist ein rein theoretischer Wert unter der Voraussetzung, dass die Temperatur des Brennstoffs vor dem Brennen und die der Verbrennungsprodukte 25 ˚C betragen. Da die meisten Brennstoffe unter an- 2.4.2 Was ist Verbrennung? – Seite 7 – 01.04.2010<<>>derem Wasser enthalten, unterscheidet sich der Brennwert vom Heizwert vor allem durch die Kondensationswärme des Wassers.
In grober Näherung kann folgende Formel angegeben werden:
Brennwert (Hs) = Heizwert (Hi + Verdampfungswärme des Wassers
Hi < Hs
Der Heizwert ist daher in der Regel geringer als der Brennwert.
Da allgemein bei Feuern die Verbrennungsgase bei hoher Temperatur abtransportiert werden, ist der Heizwert von größerer praktischer Bedeutung und stellt die bei der Verbrennung maximal nutzbare Energie pro Masse Brennstoff dar.
Tab. 2: Beispiele für Heizwerte
Stoffe | in M|/kg bei 0 ºC und 1.013 mbar |
|---|---|
Holzkohle | 29,8 |
Braunkohle jünger (älter) | 7,5 bis 9,2 (1 7,6 bis 23,5) |
Steinkohle | 26,0 bis 33,5 |
Aluminium | 29,3 |
Motorenbenzin | 41,0 bis 44,0 |
Dieselkraftstoff | 42,3 bis 43,1 |
Heizöle, leicht (schwer) | 40,2 bis 42,3 (39,4 bis 40,2) |
Erdöl | 39,8 bis 41,9 |
Acetylen | 48,7 2.4.2 Was ist Verbrennung? – Seite 8 – 01.04.2010<< |
Einheit der Enthalpie: kJmol-1
DIN EN 437 ersetzt Hu
DIN EN 437 ersetzt Ho
Jeder Stoff besitzt eine Masse (Gewicht), hat ein Volumen (Platzbedarf) und besitzt »Innere Energie« (U) (Wärmeenergie). Die Form eines Körpers kann auch bei gleichem Stoff (Material) unterschiedlich sein (z.B. Eisendraht, -pulver, -blech, -kugeln, -wolle).
