Abschnitt 2.1 - 2
Entstehung von PCDD und PCDF
2.1
Voraussetzungen für die Bildung von PCDD und PCDF
Obwohl Dioxine und Furane niemals Ziel einer Produktion waren, sind sie weit verbreitet vorkommende Stoffgruppen. Ihre Bildung geschieht ungewollt, wobei als Quellen für den Eintrag in die Umwelt zum einen Produktion und Verwendung chlororganischer Produkte und zum anderen thermische Prozesse eine Rolle spielen (vgl. Abschnitt 2.2).
Dabei werden heute Neueinträge in die Atmosphäre in erster Linie durch thermische Prozesse verursacht [1]. Seit 1990 geht die Gesamtemission an Dioxinen kontinuierlich zurück. Sie dürfte zurzeit bei ca. 0,3 bis 1,0 kg TE2 pro Jahr liegen, während in den 80er Jahren noch 1 bis 2 kg TE pro Jahr (zuzüglich des Eintrags durch Erzeugung und Verwendung chlororganischer Produkte) emittiert wurden. Es ist zu erwarten, dass sich dieser Trend - bedingt durch Maßnahmen zur Emissionsminderung - weiter fortsetzen wird [2].
Die relativ leichte Bildung von Dioxinen und Furanen ist darauf zurückzuführen, dass die Strukturen der entstehenden Verbindungen (vgl. Abschnitt 1) äußerst stabile Atomanordnungen darstellen, die zudem in Abhängigkeit von ihrem Chlorierungsgrad gegenüber Reaktionen mit Sauerstoff geschützt sind [3].
Hauptbildungsweg bei der Entstehung von Dioxinen und Furanen dürften Reaktionen mit den entsprechenden Vorläufersubstanzen sein. Wichtige Vorläufersubstanzen sind z.B. Chlorphenole oder Chlorbenzole, wie sie z.B. bei der Herbizidherstellung (Unkrautvernichter) notwendig sind [4], [5].
Dioxine bilden sich jedoch auch ohne die vorgenannten organischen Vorläufermoleküle. So genügt es, wenn Chlor in Form anorganischer Salze vorliegt. Bei gleichzeitiger Anwesenheit von Kohlenstoff und Sauerstoff kann es bei Temperaturen oberhalb 250 °C zur Dioxinbildung kommen. Diese als "De-Novo-Synthese" [6] bezeichnete Radikalreaktion wird durch Kupfer und andere Metalle katalysiert.
Dioxine und Furane entstehen bei jeder Art von Pyrolyseprozessen/Verbrennungsvorgängen, an denen neben Kohlenstoffverbindungen auch anorganische oder organische Chlor- bzw. Halogenverbindungen beteiligt sind.
Ein Eintrag von Dioxinen in die Umwelt hat also bereits im vorindustriellen Zeitalter stattgefunden, etwa durch Waldbrände, beim Verglimmen von Torf oder durch die früher übliche Verfeuerung von Holz zu Heizzwecken [7].
Aber auch der normale Hausbrand, die normale Verheizung von Holz wie auch von Kohle in Haushalten, führt zu einer Bildung und damit Emission von Dioxinen. Schätzungsweise sind ca. 1,5 % der Naturstoffe chlorhaltig [8]. Jedoch geht man davon aus, dass früher die Dioxinbelastung annähernd um den Faktor 100 niedriger war als heute. Der rapide Anstieg der Dioxinbelastung in den Jahren 1920 bis 1950 ist mit hoher Wahrscheinlichkeit auf Einflüsse durch den Menschen zurückzuführen.
Die relativ mäßigen Temperaturen bei konventionellen Verbrennungsprozessen bieten gute physikalisch-chemische Voraussetzungen für die Bildung von Dioxinen und Furanen. Im Temperaturbereich um 300 °C verläuft die Bildung am schnellsten und nimmt dann bis 600 °C wieder ab. Sauerstoffmangel und die Anwesenheit von Kupfersalzen fördern die Bildung im niedrigen Temperaturbereich. Auf der anderen Seite sorgen Kupfersalze bei Temperaturen über 600 °C auch für einen schnelleren Zerfall der Dioxine/Furane. Allerdings hatte die Zugabe von Kupfersalzen in Müllverbrennungsanlagen keinen Einfluss auf Bildungs- oder Rückbildungsmechanismen von Dioxinen. Generell lässt sich feststellen, dass Dioxine und Furane im Temperaturbereich zwischen 600 °C und 800 °C relativ stabil sind und erst bei weiterer Temperaturerhöhung ein merklicher Zerfall durch Pyrolyse oder durch Reaktion mit Sauerstoff beobachtet wird.
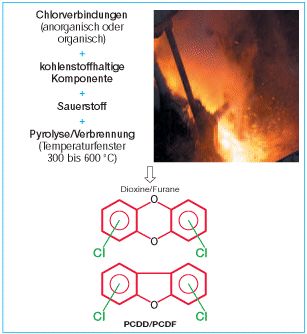
Bild 2-1: Schema des Bildungsmechanismus von PCDD/PCDF
Literatur
- [1]
Report der gewerblichen Berufsgenossenschaften, der Unfallversicherungsträger der öffentlichen Hand und des BGIA: Dioxine am Arbeitsplatz, Druck Center Meckenheim (1997)
- [2]
Batz, R.: Ergebnisse und Schlussfolgerungen aus dem Dioxinmessprogramm bei Anlagen zur Gewinnung von Metallen, UTA Umwelt Technologie Aktuell 7, Heft 3/96, 242-248 (1996)
- [3]
Ballschmiter, K.: Chemie und Analytik der Polychlordibenzodioxine (Dioxine) und Polychlordibenzofurane (Furane). "Dioxin in der Umwelt", VCI Schriftenreihe 1/85, 8-12 (1985)
- [4]
Ballschmiter, K.; Zoller, W.; Scholz, Ch.; Nottrodt A.: Occurrence and absence of polychlorodibenzofurans and polychlorodibenzodioxins in fly ash from municipal incinerators. Chemosphere 12, 585-594 (1983)
- [5]
Dransfeld P.: Mechanismen der Dioxinbildung und -zerstörung. Vortrag im Rahmen des Seminars "Dioxinund NOX-Minimierungstechniken" am 17./18. September 1991
- [6]
Hagenmaier, H. et. al.: Dioxin - eine technische, analytische, ökonomische und toxikologische Herausforderung VDI-Berichte 634, VDI-Kommission Reinhaltung der Luft, S. 557-584, VDI-Verlag, Düsseldorf, 1987
- [7]
Meharg, A. A. und Killham, K.: A pre-industrial source of dioxins and furans. Nature, 421, 909-910 (2003)
- [8]
Geckeler, K. E.; Eberhardt W.: Biogene Organochlorverbindungen - Vorkommen, Funktion, Umweltrelevanz. Naturwissenschaften 82, 2-11 (1995)
TE = Toxizitätsäquivalente, vgl. Abschnitt 1.3
