2.4.3 Triebkraft der Verbrennung
Inhaltsübersicht
Eine Verbrennung läuft nach der Entzündung so lange freiwillig ab, bis entweder der brennbare Stoff oder der Sauerstoff verbraucht ist.
Die Triebkraft der Verbrennung wird durch zwei grundlegende Gesetze definiert:
Hinweis:
- a)
Die Natur ist bestrebt, den energieärmsten Zustand einzunehmen. Die Energie der Stoffe eines Systems wird durch deren Enthalpie (H) beschrieben.
- b)
Die Natur ist bestrebt, den Zustand größtmöglicher Unordnung anzunehmen. Der Unordnungszustand eines Systems wird durch die Entropie (S) beschrieben.
Enthalpie und Entropie wirken gegeneinander, eine Zustandsgröße, die diese Wechselwirkung beschreibt, ist die Freie Enthalpie (G). Bei einer chemischen Reaktion sind die Enthalpien und Entropien der Produkte verschieden denen der Edukte.
Gibbs-Helmholtz'sche Gleichung: ΔG = ΔH – T · ΔS
Darin bedeutet:
ΔG = Änderung der Freien Enthalpie | = GProdukte – GEdukte |
|---|---|
ΔH = Änderung der Enthalpie | = HProdukte – HEdukte |
ΔS = Änderung der Entropie | = SProdukte – SEdukte |
Im Bezug auf die Freie Enthalpie können bei einer Reaktion drei Zustände auftreten:
ΔG < 0 → | selbstständig ablaufende Reaktion (die Freie Enthalpie nimmt ab, Reaktionen dieser Art werden als exergonisch bezeichnet). |
|---|---|
ΔG = 0 → | Reaktion ist im Gleichgewicht, keine Änderung des Systems (die Freie Enthalpie nimmt weder zu noch ab). |
ΔG > 0 → | unmögliche Reaktion bzw. Reaktion läuft in Gegenrichtung ab (die Freie Enthalpie nimmt zu, Reaktionen dieser Art werden als endergonisch bezeichnet). |
Eine exotherme Reaktion (ΔH < 0) mit einem positiven ΔS-Wert läuft immer freiwillig ab, wie man an folgendem Beispiel sehen kann:
H2 + Br2 → 2 HBr
£H = -72,47 kJ – T · £S: +34,02 kJ → £G: = –106,49 kJ
2.4.3 Triebkraft der Verbrennung – Seite 2 – 01.04.2010>>Bei einem großen £H-Wert ist auch trotz einer ungünstige Entropieänderung (sprich: negativer £S-Wert) £G negativ:
2 H2 + O2 → 2 H2O
£H = -571,10 kJ – T ·∙£S: -97,28 kJ → £G = -474,42 kJ
Im Gegensatz dazu kann auch ein großer positiver Wert für T-£S gegenüber einer ungünstigen Reaktionsenthalpie (sprich: AH positiv) überwiegen:
Br2 + Cl2 → 2 BrCl
£H = +29,37 kJ – T ·∙£S: +31,17 kJ → £G = –1,80 kJ
Der Betrag von AH ist bei 25 ºC und 101,3 kPa meistens erheblich größer als der Betrag von T · £S. Unter solchen Bedingungen verlaufen exotherme Reaktionen freiwillig, unabhängig von der Entropieänderung im System. Mit steigender Temperatur nimmt die Bedeutung von T-£S zu. In der Regel ändern sich AH und AS nur wenig mit der Temperatur, während im Produkt T · £S die Temperatur selbst vorkommt. Bei hohen Temperaturen kann der Ausdruck T · £S maßgebend für AG sein. In folgendem Beispiel sind £H und £S beide positiv:
2 Ag2O → 4 Ag + O2
£H = +61,17 kJ – T · £S: +39,50 kJ → £G = +21,67 kJ
Bei 25 ºC ist £H größer als T · £S, daher ist AG positiv und die Reaktion läuft nicht ab. Bei 300 ºC ist T∙· £S = +75,95 kJ, es ergibt sich für £G hingegen ein negativer Wert und die Reaktion läuft ab.
Verbrennungsgeschwindigkeit
Die Reaktionsgeschwindigkeit (vRG) allgemein wird durch die Änderung der Konzentration der an der Reaktion beteiligten Stoffe in Abhängigkeit der Zeit definiert (d.h. die Konzentration der beteiligten Stoffe zu Beginn und zum Schluss; die verstrichene Zeit ist dabei die Reaktionsgeschwindigkeit).
Die Reaktionsgeschwindigkeit hängt von folgenden Faktoren ab:
Konzentration: Die Reaktionsgeschwindigkeit steigt mit der Konzentration. Sind mehr Teilchen vorhanden, so erhöht sich die Wahrscheinlichkeit von Zusammenstößen.
Art der Reaktion: Die meisten Reaktionen laufen über mehrere Teilschritte mit jeweils unterschiedlichen Geschwindigkeiten ab. Die Reaktionsgeschwindigkeit der Gesamtreaktion wird dabei von dem langsamsten Teilschritt bestimmt.
2.4.3 Triebkraft der Verbrennung – Seite 3 – 01.04.2010<<>>Aktivierungsenthalpie: Beim Zusammenstoß von Teilchen kommt es oft zu Umgruppierungen; meist werden Atomanordnungen durchlaufen, die einen höheren Energiegehalt als Ausgangs- und Endzustand haben. Um diesen energiereichen Übergangszustand zu erreichen, benötigt man Energie, die als Aktivierungsenthalpie bezeichnet wird. Sie bildet eine Barriere zwischen Anfangs- und Endzustand.
Katalysatoren: Katalysatoren beeinflussen die Geschwindigkeit einer Reaktion, ohne dabei selbst verbraucht zu werden. Sie erzielen dadurch einen neuen Reaktionsverlauf, der eine geringere Aktivierungsenergie besitzt.
Bezieht man die Reaktionsgeschwindigkeit auf die Verbrennung, kommt man auf die Verbrennungsgeschwindigkeit.
Damit die Stoffe miteinander reagieren können, müssen die betroffenen Teilchen zusammenstoßen. Bei der Verbrennung heißt das, dass die Teilchen des brennbaren Stoffes mit denen des Sauerstoffs zusammenstoßen. Je mehr Stöße pro Zeit, umso höher ist die Verbrennungsgeschwindigkeit. Daher ist die Verbrennungsgeschwindigkeit umso größer, je schneller die Konzentration der Verbrennungsprodukte zunimmt.
Die Verbrennungsgeschwindigkeit hängt daher stark von der Konzentration des brennbaren Stoffes bzw. Sauerstoffes ab. Daraus lässt sich ableiten, dass eine Verbrennung bei hoher Sauerstoffkonzentration schneller abläuft und umgekehrt deutlich langsamer.
Die Verbrennungsgeschwindigkeit hängt auch vom Verteilungsgrad eines brennbaren Stoffes (er wird durch das Verhältnis Oberfläche zur Masse des brennbaren Stoffes definiert) und dem Zustand des brennbaren Stoffes ab. So verbrennen brennbare Stäube fester Stoffe und brennbare Gase in enorm kurzer Zeit. Je feiner die Verteilung eines brennbaren Stoffes, desto größer ist die Verbrennungsgeschwindigkeit, da der Sauerstoff fast ungehindert hinzukommt.
Um die Verbrennungsgeschwindigkeit angeben zu können, bestimmt man die Abbrandrate. Die Abbrandrate ist die Masse eines brennbaren Stoffes, der in einer bestimmten Zeit verbrennt.
Neben den beteiligten Stoffen spielt auch die Temperatur eine große Rolle bei der Reaktionsgeschwindigkeit. Eine Beziehung, die den Zusammenhang zwischen der Temperatursteigerung und der Zunahme der Reaktionsgeschwindigkeit beschreibt, ist die RGT-Regel oder van't Hoffsche Regel.
Sie besagt, dass durch eine Temperaturzunahme von 10 ºC die Reaktionsgeschwindigkeit um das Doppelte bis Dreifache gesteigert wird.
2.4.3 Triebkraft der Verbrennung – Seite 4 – 01.04.2010<<>>Diese Regel gilt aber nur unter folgenden Umständen:
Die Reaktion muss eindeutig sein und in wenigen Teilschritten ablaufen.
Alle Reaktionspartner müssen im gleichen Aggregatzustand vorliegen (homogen). Die Reaktion muss in großer Verdünnung ablaufen.
Die Reaktionstemperatur muss unter 200 ºC sein.
Da Verbrennungen heterogene Reaktionen sind, meistens hohe Temperaturen erreicht werden, mehrere Reaktionen nebeneinander ablaufen und die Reaktionspartner in hoher Konzentration vorliegen, ist die van't Hoffsche Regel für exakte Berechnungen bei Verbrennungsreaktionen nicht geeignet.
Bestimmend für die Verbrennungsgeschwindigkeit ist hauptsächlich der Stofftransport (d.h. Heranführen von Sauerstoff, Abtransport der Verbrennungsprodukte). Diese Diffusion (= Stofftransport) ist temperaturabhängig, so dass sich eine Änderung der Reaktionsgeschwindigkeit durch die Temperaturabhängigkeit des Stofftransports ergibt. In diesem Fall ist eine Bezugnahme auf die van't Hoffschen Regel nicht möglich, da die Steigerung der Reaktionsgeschwindigkeit in allen Fällen geringer sein wird, als aus ihr abzuleiten ist.
2.4.3.1 Verbrennung und chemisches Gleichgewicht
Betrachtet man die Reaktion A + B → C + D, so wird man feststellen, dass sie umso schneller abläuft, je größer die Konzentration von A und B ist und je geringer die von C + D ist. Umgekehrt ist auch die Rückreaktion C + D → A + B möglich. Auch bei der Rückreaktion gilt: Je größer die Konzentration von C und D und je geringer die von A und B, desto größer ist die Geschwindigkeit. Diese beiden Reaktionen laufen nebeneinander ab. Irgendwann wird die Geschwindigkeit von Hin- und Rückreaktion gleich groß sein und die Konzentrationen der beteiligten Stoffe werden sich nicht mehr ändern. Es findet zwar noch immer die Reaktion A + B → C und D statt, doch in der gleichen Zeit und Menge läuft auch die Reaktion C + D → A und B ab. Der Beobachter glaubt daher, dass die Reaktion zum Erliegen gekommen ist. Diesen Zustand nennt man in der Chemie ein chemisches Gleichgewicht.
Überträgt man das chemische Gleichgewicht auf die Brandlehre, so kann man dies am Beispiel eines Brandes in einem abgeschlossenen Zimmer verdeutlichen. Bei dem Brand werden mit der Zeit die Konzentrationen von brennbarem Stoff und Sauerstoff abnehmen und die Konzentrationen der Verbrennungsprodukte zunehmen. Dadurch nimmt die Geschwindigkeit der Hinreaktion (der Verbrennung) ab und die Geschwindigkeit der Rückreaktion nimmt zu. Es wird irgendwann zu einem Zustand kommen, bei dem die Geschwindigkeit der Hinreaktion gleich der der Rückreaktion ist. Die Verbrennung kommt fast zum Erliegen, obwohl 2.4.3 Triebkraft der Verbrennung – Seite 5 – 01.04.2010<<>>noch brennbare Stoffe und auch Sauerstoff vorhanden sind (Übergang zum Schwelbrand).
Wird in diesem Zustand das geschlossene System in ein offenes umgewandelt, so kann Sauerstoff hinzutreten und die Verbrennungsprodukte können abgeführt werden. Dadurch, dass die Konzentration des Sauerstoffs wieder zunimmt, nimmt auch die Geschwindigkeit der Hinreaktion stark zu und die Geschwindigkeit der Rückreaktion ab. Dies ist der Fall beim Übergang vom Schwelbrand zum Vollbrand, besonders spektakulär beim Flashover und Backdraft.
Dieses Phänomen des Übergangs vom Schwelbrand zum erneuten Vollbrand lässt sich auch durch das Prinzip des kleinsten Zwanges von Le Chatelier (frz. Chemiker, 19. Jh.) erklären:
Wird auf ein System, das sich im Gleichgewicht befindet, durch Ändern der äußeren Bedingungen ein Zwang ausgeübt, so verschiebt sich das Gleichgewicht derart, dass es dem Zwang ausweicht bzw. ihn zu vermeiden sucht.
Das heißt, findet in einem abgeschlossenen Raum eine Verbrennung statt, so erhöht sich der Druck im Raum. Da die Verbrennungsprodukte nicht entweichen können, steigt deren Konzentration. Die Reaktion versucht, diesem Zwang auszuweichen, indem sie die Produktion der Verbrennungsprodukte vermindert, sie verringert also die Verbrennungsgeschwindigkeit und der Brand geht in einen Schwelbrand über. Wird dieser Raum geöffnet, so können die Verbrennungsprodukte entweichen. Es wirkt jetzt ein entgegengerichteter Zwang. Um diesen zu umgehen, produziert die Reaktion wieder vermehrt Verbrennungsprodukte und die Verbrennungsgeschwindigkeit steigt an.
2.4.3.2 Voraussetzung für eine Verbrennung
Damit eine Verbrennung überhaupt möglich ist, müssen stoffliche und energetische Voraussetzungen gegeben sein.
Es muss ein brennbarer Stoff vorhanden sein.
Sauerstoff muss ungehindert Zutritt zum brennbaren Stoff haben.
Das richtige Mengenverhältnis (Konzentration) von brennbarem Stoff und Sauerstoff muss gegeben sein.
Die Zündtemperatur des brennbaren Stoffes muss erreicht sein und
ggf. ein Katalysator.
Wird einer dieser Punkte weggenommen, so kann die Verbrennung nicht mehr weiter verlaufen.
2.4.3 Triebkraft der Verbrennung – Seite 6 – 01.04.2010<<>>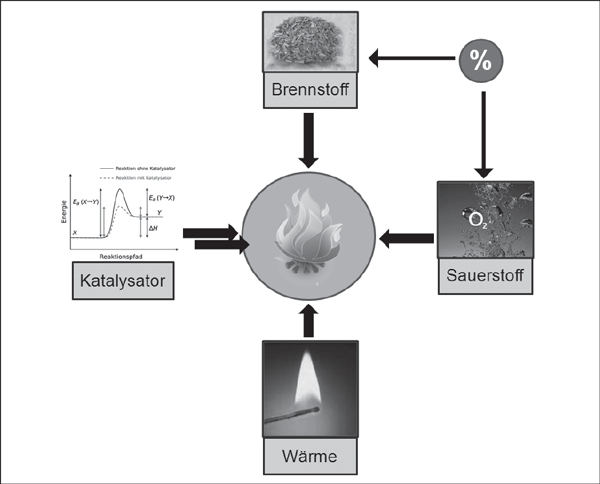
2.4.3.3 Brennbare Stoffe
Brennbare Stoffe sind feste, flüssige oder gasförmige Stoffe einschließlich Dämpfen, Nebeln oder Stäuben, die im Gemisch mit Sauerstoff und einer geeigneten Zündquelle zum Brennen angeregt werden können.
Brennbare Stoffe können auf verschiedenste Art und Weise eingeteilt werden:
nach Brennbarkeit
nach dem Flammpunkt
nach der Zündtemperatur
nach der Mindestzündenergie
nach der Grenzspaltweite oder
die bekannteste nach dem Brandverhalten
Brennbare Stoffe, die nach dem Brandverhalten beurteilt werden, werden in fünf so genannte Brandklassen eingeteilt:
Die Brandklasseneinteilung dient der Zuordnung zweckmäßiger Löschmethoden und ihrer Löschmittel zu den einzelnen brennbaren Stoffen.
2.4.3 Triebkraft der Verbrennung – Seite 7 – 01.04.2010<<>>Tab. 1: Brandklasseneinteilung nach Löschmitteln
Brandklasse | Brände | Beispiel | Geeignete Löschmittel |
|---|---|---|---|
 | feste Stoffe | Holz, Kohle, Gummi |
|
 | flüssige und flüssig werdende Stoffe | Wachs, |
|
 | brennbare Gase | Propan, |
|
 | Metalle | Aluminium, Magnesium |
|
 | Fettbrände | Brände von Speiseölen und Speisefetten |
|
Brennbare Stoffe können nach allgemeinen chemischen und physikalischen Gesichtspunkten eingeteilt werden. Bei den verschiedenen Kriterien, die zur Beurteilung der brennbaren Stoffe, insbesondere nach chemischen Gesichtspunkten, herangezogen werden, muss die Abhängigkeit der Eigenschaften eines Stoffes von der Art seiner chemischen Bindung berücksichtigt werden. Die Bindungsart des Stoffes ist für seine charakteristischen Eigenschaften von entscheidender Bedeutung. Die Abhängigkeit des Brandverhaltens der Stoffe von ihrer Bindungsart zeigt Tabelle 2.
2.4.3 Triebkraft der Verbrennung – Seite 8 – 01.04.2010<<>>Tab. 2: Merkmale und Verhalten von Stoffen mit Atom- oder Ionenbindung
Art der Bindung | Bindungskräfte | Temperaturbeständigkeit/elektrische Leitfähigkeit | Beispiele |
|---|---|---|---|
Atombindung Bindung der Atome im Molekül durch gemeinsame Elektronenpaare |
|
| Methan, Benzin, Holz, Kunststoffe, organische, meist brennbare Stoffe, die mit verhältnismäßig geringem Energieaufwand thermisch aufbereitet werden können, deren chemische Reaktion mit dem Sauerstoff aber erst nach Erreichen verhältnismäßig hoher Zündtemperaturen möglich ist; der eingeleitete Vorgang des Brennens läuft dann aber selbstständig ab, da bei der Bildung der Oxide ein großer Energiegewinn erfolgt |
|
| ||
Ionenbindung Anziehen der Ionen im Kristallgitter durch entgegengesetzte Ladung |
|
| Salze, Löschpulver, anorganische, meist nicht brennbare Stoffe; durch die stabilen Bindungsverhältnisse sind ein Zerfall dieser Stoffe und die exotherme Reaktion mit dem Sauerstoff nur schwer möglich |
|
|
Das Brandverhalten eines Stoffes ist aber nicht nur von seinen chemischen Eigenschaften, sondern auch von seinen physikalischen Zustandsbedingungen abhängig. So übt der Aggregatzustand des brennbaren Stoffes einen großen Einfluss auf das richtige Löschverfahren aus, da die Feuererscheinungen (Flamme und/oder Glut) davon abhängig sind, ob der Stoff unter normalen Zustandsbedingungen fest, flüssig oder gasförmig vorliegt. Auch in der DIN V 14011 werden die physikalischen Unterschiede bei der Definition der brennbaren Stoffe hervorgehoben:
Brennbare Stoffe sind gasförmige, flüssige oder feste Stoffe, einschließlich Dämpfe, Nebel und Stäube, die im Gemisch oder im Kontakt mit Luft oder Sauerstoff zum Brennen angeregt werden können.
Ein weiteres wichtiges Kriterium für brennbare Stoffe ist die Entzündbarkeit. Nach DIN V 14011 ist sie folgendermaßen definiert:
Entzündbarkeit ist die Eigenschaft von brennbaren Stoffen oder Stoffmengen, die mehr oder weniger leicht entzündet werden können. Entzünden ist das Einleiten des Brennens. 2.4.3 Triebkraft der Verbrennung – Seite 9 – 01.04.2010<<>>
Die besondere Gefährlichkeit eines brennbaren Stoffes ergibt sich erst, wenn er brennt. Aufgrund der Unterscheidung von Oxidationen mit und ohne Feuererscheinung kann festgestellt werden, dass der brennbare Stoff umso gefährlicher ist, je höher seine Oxidationsgeschwindigkeit ist. Das Brennen, d.h. eine Oxidation mit Feuererscheinung, ist erst bei einer mehr oder weniger großen Oxidationsgeschwindigkeit möglich. Beim Erreichen dieser bestimmten Oxidationsgeschwindigkeit wird der Vorgang des Brennens eingeleitet. Das Entzünden eines Stoffes kann also als Übergang der langsamen Oxidation zu der schnellen Oxidation mit Feuererscheinung angesehen werden. Die Gefahren des Brennens und damit die Einwirkung der auftretenden Brandtemperatur (Verbrennungstemperatur) auf den brennbaren Stoff selbst und seine Umgebung erfolgt erst nach dem Entzünden. Eine Aussage über die Entzündbarkeit würde daher eine Beurteilung hinsichtlich der möglichen Auslösung von Gefahren, die von den brennbaren Stoffen ausgehen, gestatten.
2.4.3 Triebkraft der Verbrennung – Seite 10 – 01.04.2010<<